在AgCl(s)
 Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示(1)溶度积的通式:
 ,
,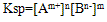
(2)溶度积规律:
①离子积:
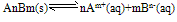 ,
,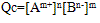
Qc为离子积,表达式中离子浓度是任意的,为此瞬间溶液的实际浓度,其值不确定,但对一难溶电解质,在一定温度下,Ksp为一定值。
②溶度积规则:
A. 当Qc>Ksp时,沉淀从溶液中析出来,体系不断析出沉淀,直至达到平衡(此时Qc=Ksp)
B. 当Qc=Ksp时,沉淀于饱和溶液平衡
C. 当Qc<Ksp时,溶液不饱和,若体系中有沉淀,则沉淀会溶解直至平衡(此时Qc=Ksp)。
相关高中化学知识点:化学平衡常数
定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
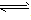 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式:
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,



化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
相关高中化学知识点:电离平衡常数
电离平衡常数:
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用
 表示,碱用
表示,碱用 表示)。
表示)。 2.表示方法:


对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用
 ,等分别表示,且
,等分别表示,且

例如:


3.影响因素:温度
 (或
(或 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下,
 越大(多元弱酸以
越大(多元弱酸以 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。相关高中化学知识点:水的离子积常数
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即
(1)在一定温度下,水的离子积都是一个常数,在25℃时
(2) 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高, 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,

(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,

溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中 的乘积总是
的乘积总是 知道
知道 就可以计算出
就可以计算出 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即 而OH-是由水电离产生的:
而OH-是由水电离产生的:
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即 而H+是由水电离产生的:
而H+是由水电离产生的:
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解



(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解


说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,
 发生水解的盐溶液中
发生水解的盐溶液中
 但
但 总成立。
总成立。
本文来自:逍遥右脑记忆 /gaozhong/936230.html
相关阅读:高中学习计划早制定
不要让高考倒计时牌打乱了考生的心态
学年度高考化学答题技巧
我国生物无机化学的发展
高一年级化学选修四知识点
