氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: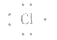
④氯的原子结构示意图: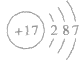
⑤氯原子的外围电子排布式: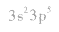
⑥化学键类型:非极性共价键
⑦氯分子的电子式: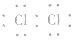
⑧氯分子的结构式: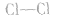
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 相关高中化学知识点:氯气用于自来水消毒杀菌
氯气的基本用途:
①消毒。(自来水常用氯气消毒,1L水里约通入0.002g氯气,消毒原理是其与水反应生成了次氯酸,它的强氧化性能杀死水里的病菌。而之所以不直接用次氯酸为自来水杀菌消毒,是因为次氯酸易分解难保存、成本高、毒性较大,则用氯气消毒可使水中次氯酸的溶解、分解、合成达到平衡,浓度适宜,水中残余毒性较少。)
②制盐酸。
③工业用于制漂白粉或漂粉精。
④制多种农药。(如六氯代苯,俗称666。)
⑤制氯仿等有机溶剂。
⑥制塑料(如聚氯乙烯塑料)等Cl?可用来制备多种消毒剂,含Cl的消毒剂有ClO?,NaClO,Ca(ClO)?。
⑦常用于将FeCl?氧化成FeCl?
⑧工业用于海水提溴(Cl?+2NaBr==Br?+2NaCl)
相关高中化学知识点:氯的其他化合物(高氯酸、氯化物、氯酸盐,盐酸等)
常见的氯化物:
(1)高氯酸:高氯酸HClO4,无色透明的发烟液体,在无机酸中酸性最强。可助燃,具强腐蚀性、强刺激性,可致人体灼伤。与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险。在室温下分解,加热则爆炸。
(2)氯化物:如氯化钠、氯化钙等,Cl-+Ag+==AgCl↓
(3)次氯酸盐:次氯酸盐是次氯酸的盐,含有次氯酸根离子ClO-,其中氯的氧化态为+1。次氯酸盐常以溶液态存在,不稳定,会发生歧化反应生成氯酸盐和氯化物。见光分解为氯化物和氧气。次氯酸盐是一种常用的漂白剂和消毒剂。在人体组织中,在亚铁血红素的髓过氧化物酶的催化作用下,过氧化物与氯化物反应可产生ClO-或HClO。这种在血球内产生的ClO-/HClO或Cl2
(4)氯酸盐:如氯酸钾在二氧化锰催化下可制取氧气
(5)盐酸:盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。工业品浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形成盐酸小液滴分散在空气中形成酸雾。
(6)氯化氢:无色或微黄色易挥发性液体,有刺鼻的气味。易溶于水与氨气反应生成氯化铵HCl+NH3==NH4Cl
卤化氢和氢卤酸、卤化银及碘化物:
1.卤化氢物理性质:卤化氢均为无色有刺激性气味的气体,均极易溶于水,在空气中都易形成酸雾。化学性质:从HF?HCl?HBr?HI,稳定性逐渐减弱,HI受热易分解;还原性逐渐增强。
2.氢卤酸:Hx溶于水后形成的溶液即氢卤酸。在氢卤酸中,除氢氟酸是弱酸外,其余皆为强酸。从氢氟酸一氢碘酸,酸性逐渐增强,还原性也逐渐增强,其中氢碘酸在空气中易被氧气氧化。
3.卤化银:

4.碘化物碘是人体必需的微量元素之一,又称“智慧元素”。人体缺碘会导致碘缺乏病(IDD),从而损害人的智力和健康。补碘最经济、方便有效的方法是食用含碘食盐。含碘食盐中加的是碘酸钾。值得注意的是,人体摄入过多的碘也是有害的,不能认为高碘的食物吃得越多越好,要根据个人的身体情况而定。
卤素单质及其化合物的特殊性:
(1)Br2是常温下唯一呈液态的非金属单质,易挥发,蒸气有毒。保存液溴要采用水封法。
(2)碘单质易升华,AgI可用于人工降雨,碘盐可用于防治甲状腺肿大。
(3)HClO4是常见含氧酸中酸性最强的酸,HClO 是氯的含氧酸中氧化性最强的酸。
(4)在卤素中,氯、溴、碘均有多种价态,但氟只有-1价和0价,而无正价。
(5)卤素单质一般不与稀有气体反应,但F,却能与Xe、Kr等稀有气体反应生成相应的氟化物。如 KrF2、XeF2、:XeF4、XeF6等。
(6)Cl2、Br2、I2的实验室制法均可用MnO2与相应的浓的氢卤酸反应制得,但F2不能用上述方法在实验室制得。
(7)卤素单质与水反应,其中Cl2、Br2、I2在反应中既是氧化剂又是还原剂,而F2与水作用时,只作氧化剂。
(8)卤素单质都能与强碱溶液反应,一般可表示为 X2+2OH-==X-+XO-+H2O(F、I除外)。
(9)碘单质遇淀粉呈现特殊蓝色。可用来鉴别碘单质或淀粉。
(10)I2在水中的溶解度很小,若在水中加入少量的KI,碘的溶解度却明显增大,这是因为发生了反应I2 +I-==I3-
(11)卤素单质与Fe作用时,除Fe+I2==FeI2 外,其他均生成+3价铁盐。常温下,干燥的液氯不与 Fe作用,故工业上可用钢瓶盛液氯。
(12)随着相对分子质量的增大,HCl、HBr、HI的熔、沸点逐渐升高。HF的相对分子质量虽比HCl小,其熔、沸点却比HCl高,是因为HF分子间存在氢键。
(13)在氧卤酸中,只有氢氟酸能与玻璃反应:SiO2 +4HF==SiF4↑+2H2O,在实验室制取HF必须在铅皿中进行。
(14)实验室制取HF、HCl分别用CaF2、NaCl与浓硫酸反应,但实验室制取HBr、HI宜用NaBr和KI与浓磷酸反应。因为生成的HBr、HI易被浓硫酸氧化生成Br2或I2。
(15)在卤化银中,AgCl、AgBr、AgI均难溶于水,且见光易分解,但AgF却易溶于水且见光不分解。
相关高中化学知识点:漂白粉、漂粉精
漂白粉,漂白精:
主要成分是次氯酸钙,工业上通过氯气与石灰乳作用制成的。2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O,在潮湿的空气里,次氯酸钙与空气中的二氧化碳和水蒸气反应,生成次氯酸。所以漂粉精、漂白粉也具有漂白、消毒作用。
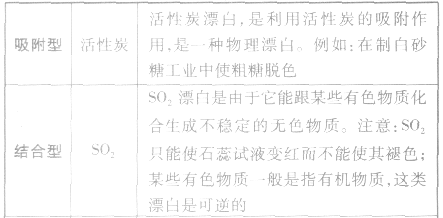
具有漂白作用的物质总结:

本文来自:逍遥右脑记忆 /gaozhong/272268.html
相关阅读:高中学习计划早制定
不要让高考倒计时牌打乱了考生的心态
我国生物无机化学的发展
学年度高考化学答题技巧
高一年级化学选修四知识点
