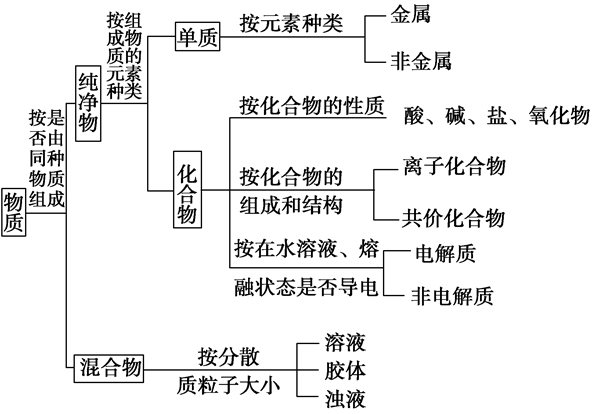
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
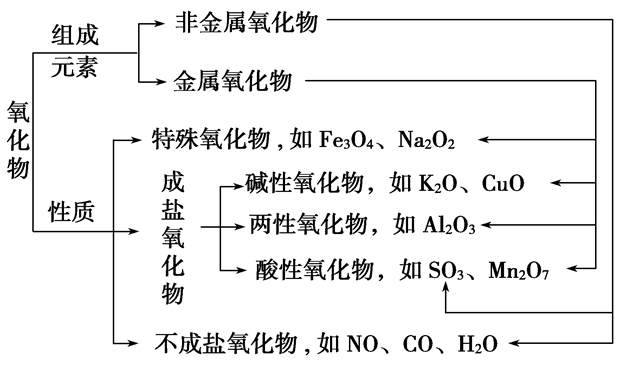
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:
氧化物的分类:
本文来自:逍遥右脑记忆 /gaozhong/265836.html
相关阅读:高一年级化学选修四知识点
我国生物无机化学的发展
学年度高考化学答题技巧
不要让高考倒计时牌打乱了考生的心态
高中学习计划早制定
