(1)与氧化剂反应生成三价铁
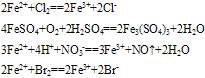
(2)与碱反应
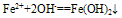
(3)Fe2+易被氧化,水溶液中易水解。亚铁盐溶液(FeCl2)在保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(HCl),防止Fe2+水解。
相关高中化学知识点:单质铁
铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 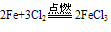
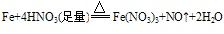
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 
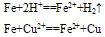
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)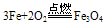

铁的性质:
物理性质:铁是黑色金属,具有铁磁性
铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
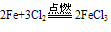
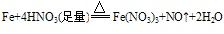
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如:

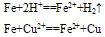
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)
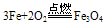

铁与稀硝酸的反应:
铁少量时:
铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
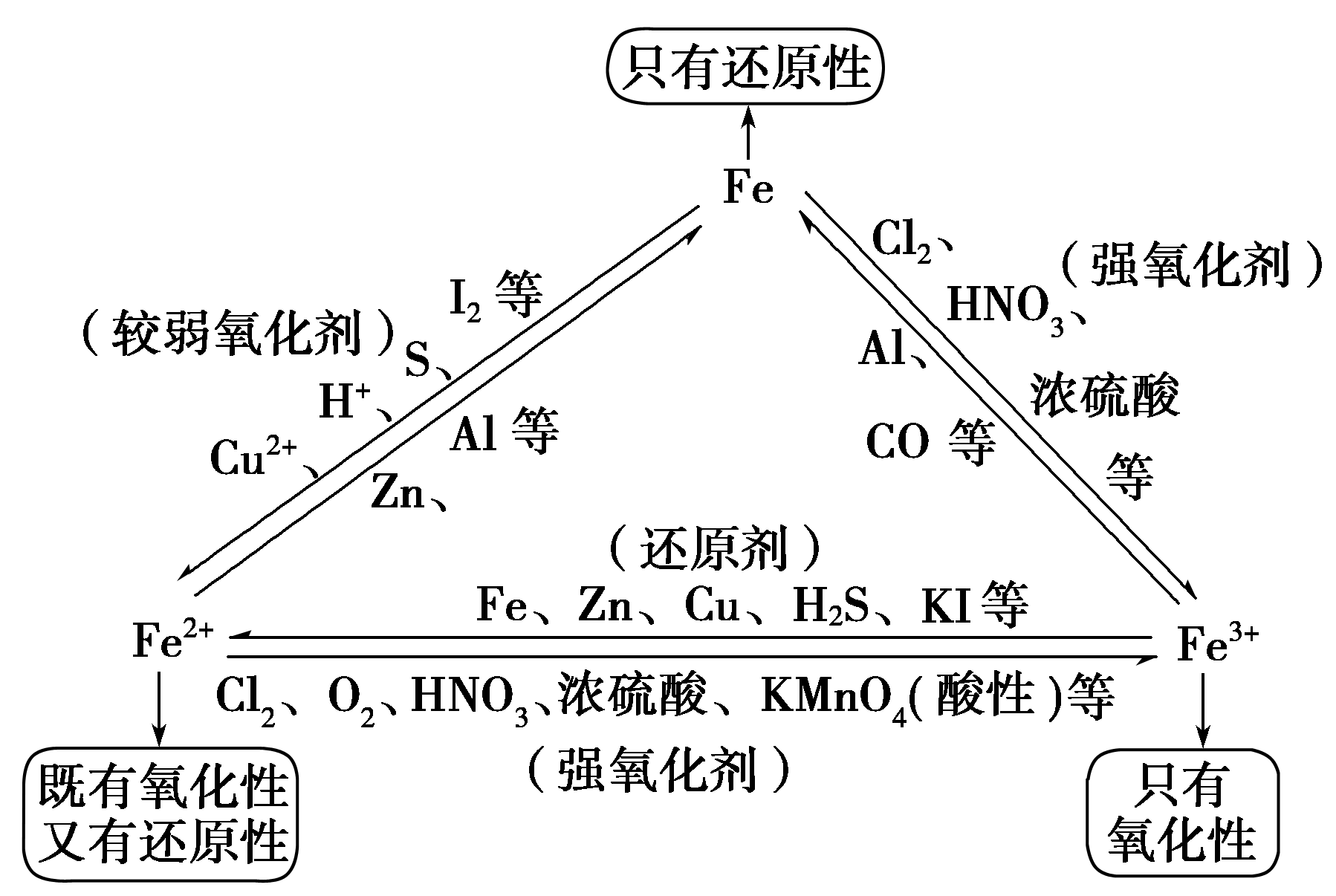
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。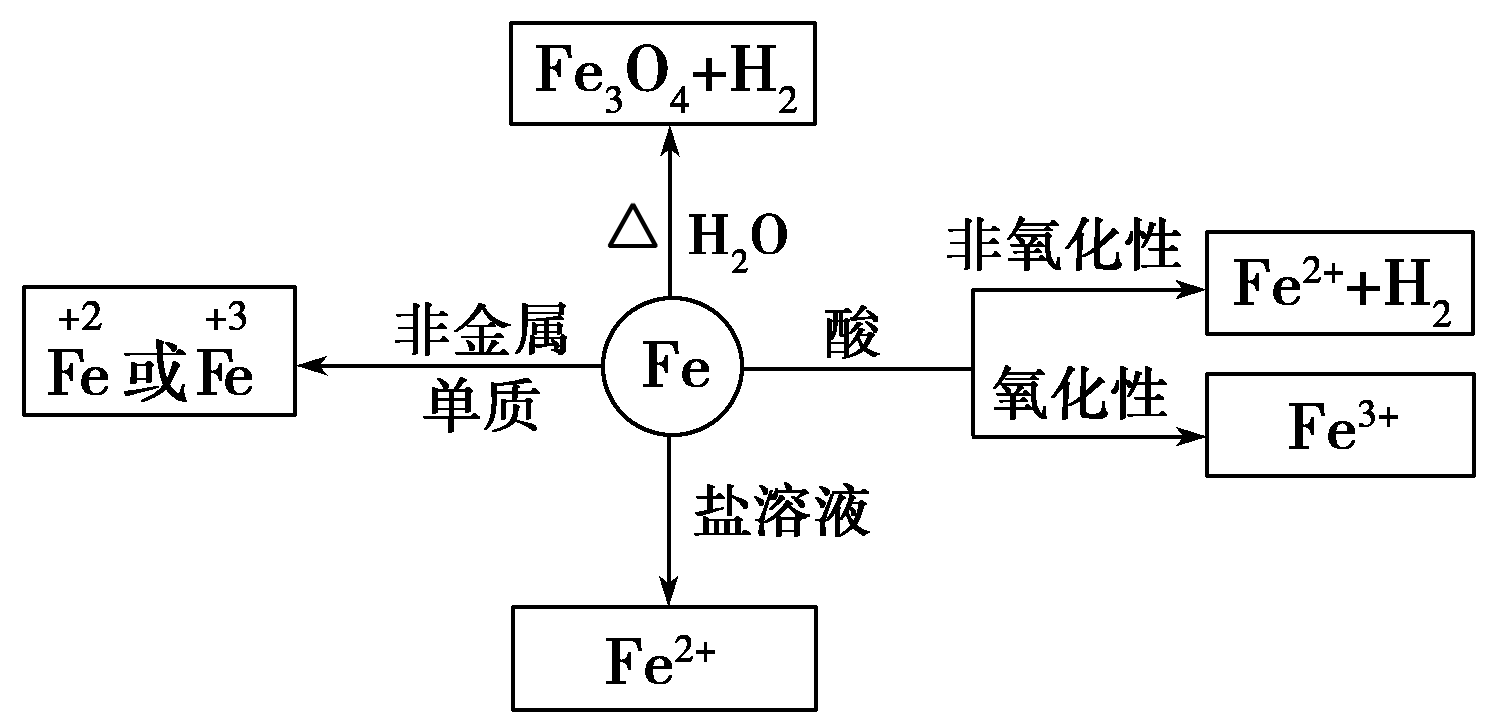
铁三角关系:
相关高中化学知识点:单质铜
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl22Cu+O2
CuCl22Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: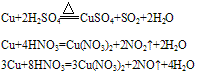
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如:Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: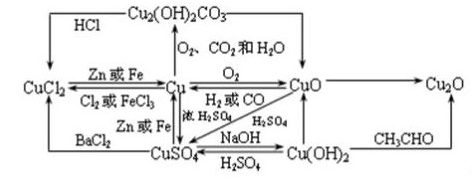
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
相关高中化学知识点:铜盐(二价铜)
硫酸铜:
五水合硫酸铜(CuSO4·5H2O)为天蓝色晶体,水溶液呈弱酸性,俗名胆矾或蓝矾。硫酸铜是制备其他铜化合物的重要原料。同石灰乳混合可得波尔多液,用作杀菌剂。硫酸铜也是电解精炼铜时的电解液。
硫酸铜的物理性质和化学性质:
(1)物理性质:白色粉末状固体,不溶于乙醇和乙醚,易溶于水,水溶液呈蓝色,是强酸弱碱盐,水溶液呈弱酸性。将硫酸铜溶液浓缩结晶,可得五水硫酸铜蓝色晶体,俗称胆矾、铜矾或蓝矾。
(2)化学性质:
①二价铜与碱反应生成蓝色沉淀Cu(OH)2,Cu(OH)2溶于氨水形成深蓝色溶液[Cu(NH3)4]2+,此性质可以检验Cu2+。无水硫酸铜遇水变成蓝色(CuSO4·5H2O),可作为水的检验的依据。
②胆矾在常温常压下很稳定,不潮解,在干燥的空气中会逐渐风化(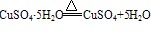 ),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
(3)Cu2+的化学性质:能被活泼金属将其从盐溶液中置换出来:例:Cu2++Fe==Cu+Fe2+
硫酸铜的用途和制法:
(1)用途:硫酸铜较重要的铜盐之一,在电镀、印染、颜料、农药等方面有广泛的应用。无机农药波尔多液就是硫酸铜和消石灰的混合液,是一种良好的杀菌剂,可防止多种作物的病害。硫酸铜也常用来制备其他铜的化合物和电解精炼铜的电解液。
(2)制法:五水合硫酸铜可由铜或氧化铜与硫酸作用后,浓缩结晶而制得。在实验室中可用浓硫酸氧化金属铜来制取无水硫酸铜。
本文来自:逍遥右脑记忆 /gaoer/520377.html
相关阅读:高二语文必修三知识点总结:劝学
高二物理学习技巧
化学高二选修1第4章同步练习:垃圾资源化
高二文科地理如何学
2014-2015学年高二化学寒假作业试题练习
