一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。在水中的溶解度甚低。空气混合爆炸极限为12.5%~74%。一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。因此一氧化碳具有毒性。一氧化碳是无色、无臭、无味的气体,故易于忽略而致中毒。常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
物理性质:
通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
化学性质:
(1)可燃性:2CO + O2
 2CO2
2CO2 (2)还原性:
一氧化碳还原氧化铜:CO+ CuO
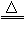 Cu + CO2
Cu + CO2 一氧化碳还原氧化铁:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 一氧化碳还原四氧化三铁:4CO+ Fe3O4
 3Fe + 4CO2
3Fe + 4CO2 (3)毒性:
CO极易和血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时危及生命。CO有剧毒,人在CO的体积分数达到 0.02%的空气中持续停留2?3h即出现中毒症状,因此我们使用煤、燃气热水器时要装烟囱,注意室内通风。
用途:
用作燃料,冶炼金属。
一氧化碳和氢气的比较
| 颜色状态 | 无色,无味气体 | 无色,无味气体 |
| 密度 | 1.250g/l(略小于空气) | 0.089g/l(最轻的气体) |
| 可燃性 | 有可燃性 2CO+O2  2CO2 2CO2 | 有可燃性 2H2+O2  2H2O 2H2O |
| 还原性 | 有还原性 CO+CuO 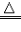 Cu+CO2 Cu+CO2 | 有还原性 H2+CuO 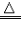 Cu+H2O Cu+H2O |
| 毒性 | 剧毒 | 无毒 |
| 鉴别方法 | 根据燃烧产物的不同鉴别 | |
H2、CO、C的比较
| H2 | C | CO | ||
| 可燃性 | 化学方程式 | 2H2+O2 2H2O 2H2O | C+O2 CO2; CO2;2C+O2  2CO 2CO | 2CO+O2 2CO2 2CO2 |
| 反应现象 | 淡蓝色火焰,放热,生成 无色液体 | 发光,放热 | 蓝色火焰,放热, 生成的无色气体 能使澄清石灰水 变浑浊 | |
| 还原性 | 方程式 | 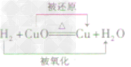 | 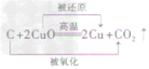 | 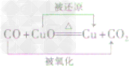 |
| 反应现象 | 黑色固体变红,生成无色液体,管口有水珠 | 黑色固体变红,生成的无色气体能使澄清石灰水变洪浑浊 | 黑色固体变红,生成的无色气体能使澄清石灰水变浑浊 | |
| 装置图 | 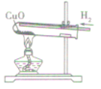 | 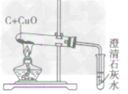 | 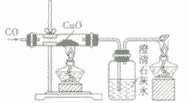 | |
| 装置要点 | 试管口略向下倾斜,导管贴试管上臂至药品上方,试管口没有橡皮塞 | 试管口略向下倾斜,导管刚过橡皮塞 | 多余的CO要进行尾气处理(如点燃) | |
| 主要步骤 | 通H2→加热→停止加热→停止通H2 | 反应结束后,先将导管从液体中取出,再停止加热 | 通CO→加热→停止加热→停止通CO | |
| 优点 | 反应条件低,生成物是水,不污染环境 | 原料便宜,操作简便 | 反应条件低 | |
| 缺点 | 不安全,操作复杂 | 反应条件高,生成物不易提纯 | 不安全,操作复杂,有毒 | |
| 用途 | 作工业原料,作高能燃料,冶炼金属 | 作燃料,冶炼金属, | 作燃料,冶炼金属, | |
(1)三种物质燃烧的现象有所不同,但不能根据火焰去鉴别CO和H2
(2)在还原CuO的实验中,必须对多余的CO进行处理
本文来自:逍遥右脑记忆 /chuzhong/263180.html
相关阅读:初中课外化学实验 检验含碘食盐成分中的碘
关于乐果的初中化学知识百科
德国化学家?瓦拉赫
初中化学?电木的来历
瑞典
