碱是指在溶液中电离成的阴离子全部是OH-的化合物。碱由金属离子(或铵根离子)和氢氧根离子构成,可用通式R(OH)n表示。从元素组成来看,碱一定含有氢元素和氧元素。
常见的碱:
(1)氢氧化钠、氢氧化钙都属于碱。除这两种碱外,常见的碱还有氢氧化钾(KOH)、氨水(NH3?H2O)、治疗胃酸过多的药物中的氢氧化铝[Al(OH)3)。
(2)晶体(固体)吸收空气里的水分.表而潮湿而逐步溶解的现象叫做潮解。氢氧化钠、粗盐、氯化镁等物质都易潮解,应保存在密闭干燥的地方。同时称量 NaOH固体时要放在玻璃器皿中,不能放在纸上,防止 NaOH固体潮解后腐蚀天平的托盘。
(3)熟石灰可由生石灰(CaO)与水反应制得,反应的化学方程式为:CaO+H2O==Ca(OH)2,反应时放出大量的热。
碱的通性
| 碱的通性 | 反应规律 | 化学方程式 | 反应类型 |
| 碱溶液与指示剂的反应 | 碱溶液能使紫色石蕊试液变蓝,无色酚酞试液变红 | ?? | ?? |
| 碱与非金属氧化物反应 | 碱+非金属氧化物→盐+水 | 2NaOH+CO2==Na2CO3+H2O Ca(OH)2+CO2==CaCO3↓+H2O | ?? |
| 碱与酸反应 | 碱+酸→盐+水 | NaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O | 复分解反应 |
| 碱与某些盐反应 | 碱1+盐1→碱2+盐2 | 2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 Ca(OH)2+Na2CO3==CaCO3↓+2NaOH | 复分解反应 |
| 碱+铵盐→氨气+水+盐 | NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O | 复分解反应 |
常见的碱有NaOH、KOH、Ca(OH)2、氨水的特性:
①氢氧化钠(NaOH)俗名苛性钠、火碱、烧碱,这是因为它有强腐蚀性。NaOH是一种可溶性强碱。白色固体,极易溶于水,暴露在空气中易潮解,可用作碱性气体(如NH3)或中性气体(如H2、O2、CO等)的干燥剂。NaOH易与空气中的CO2反应生成Na2CO3固体。NaOH溶液可以腐蚀玻璃,盛NaOH溶液的试剂瓶不能用磨口的玻璃塞,只能用橡胶塞。
②氢氧化钙[Ca(OH)2]是白色粉末,微溶于水,俗称熟石灰或消石灰,其水溶液称为石灰水。Ca(OH)2也有腐蚀作用。Ca(OH)2与CO2反应生成白色沉淀CaCO3,常用于检验CO2。 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2能跟Na2CO3反应生成NaOH,用于制取NaOH。反应方程式为: Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③氨水(NH3?H2O)是一种可溶性弱碱,NH3溶于水可得氨水。有刺激性气味,有挥发性。将氨气通过盛放氧化铜的玻璃管,生成氮气、水和铜,其反应方程式为: 2NH3+3CuO=(加热)=3Cu+N2↑+3H2O,说明氨气具有还原性。
此外,KOH、Ba(OH)2也是常见的可溶性强碱。不溶的碱大多是弱碱,如:Fe(OH)3、Cu(OH)2等。他们的共同性质是热稳定性差,受热易分解生成对应的金属氧化物和水。
氢氧化钠、氢氧化钙的物理性质和用途比较
| 俗名 | 苛性钠,火碱,烧碱 | 熟石灰,消石灰 |
| 颜色、状态 | 白色,片状固体 | 白色,粉末状固体 |
| 腐蚀性 | 强烈腐蚀性 | 较强腐蚀性 |
| 溶解性 | 易溶于水,易潮解,溶解时放热 | 微溶于水,其水溶液俗称石灰水 |
| 用途 | 化工原料,用于肥皂、石油、纺织、印染工业等;生活中用于除油污 | 用于建筑工业,制漂自粉,改良土壤,配制农药等 |
氢氧化钠、氢氧化钙化学性质的比较
| 氢氧化钠 | 氢氧化钙 |
| 跟指示剂作用.使紫色石蕊试液变成蓝色,使无色酚酞试液变成红色 | 跟指示剂作用,使紫色石蕊试液变成蓝色,使无色酚酞试液变成红色 |
| 跟某些非金属氧化物反应 2NaOH+CO2==Na2CO3+H2O 2NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O | 跟某些非金属氧化物反应 Ca(OH)2+CO2==CaCO3↓+H2O Ca(OH)2+SO2==CaSO3↓+H2O Ca(OH)2+SO3==CaSO4+H2O |
| 跟酸发生中和反应 2NaOH+H2SO4==Na2SO4+2H2O | 跟酸发生中和反应 Ca(OH)2+H2SO4==CaSO4+2H2O |
| 跟某些盐反应 2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 | 跟某些盐反应 Ca(OH)2+Na2CO3==CaCO3↓+2NaOH |
几种碱的颜色和溶解度
| 碱 | 颜色 | 溶解性 |
| NaOH、KOH、Ba(OH)2 | 白色 | 易溶 |
| Ca(OH)2 | 白色 | 微溶 |
| Mg(OH)2、Al(OH )3、Fe(OH )2 | 白色 | 难溶 |
| Fe(OH )3 | 红褐色 | 难溶 |
| Cu(OH)2 | 蓝色 | 难溶 |
概念性质的理解
①氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沽到皮肤.上或洒在衣服上。如果不慎将碱液沽到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
②浓硫酸、氢氧化钠固体溶于水放热,属于物理变化;而氧化钙溶于水放热是氧化钙与水反应放出大量的热,属于化学变化;生石灰具有强烈的吸水性,可以作某些气体的干燥剂。
③由于NaOH易潮解,同时吸收空气中的CO2发生变质,所以NaOH必须密封保存。
④保存碱溶液的试剂瓶应用橡胶塞、不能用玻璃塞,以防止长期不用碱溶液,碱溶液腐蚀玻璃造成打不开的情况。
⑤只有可溶性碱溶液才能使指示剂变色,如NaOH溶液能使无色酚酞变红;但不溶性碱不能使指示剂变色,如Mg(OH)2中滴加无色酚酞,酚酞不变色。
⑥盐和碱的反应,反应物中的盐和碱必须溶于水,生成物中至少有一种难溶物、气体或H2O。铵盐与碱反应生成的碱不稳定,分解为NH3和H2O。
⑦碱与酸的反应中碱可以是不溶性碱,如 Cu(OH)2+H2SO4==CuSO4+2H2O。
氢氧化钠和氢氧化钙的鉴别:
NaOH与Ca(OH)2的水溶液都能使酚酞变红,故鉴别NaOH和Ca(OH)2不能用指示剂,通常情况下,可采用以下两种方法来鉴别NaOH和Ca(OH)2
方法一:通入CO2气体,NaOH溶液与CO2气体反应后无明显现象,但Ca(OH)2溶液即澄清石灰水与 CO2反应生成白色沉淀。
方法二:滴加Na2CO3溶液或K2CO3溶液,NaOH溶液与K2CO3,Na2CO3溶液不反应,但Ca(OH)2溶液与 Na2CO3、K2CO3溶液反应均生成白色沉淀。Ca(OH)2+ Na2CO3==CaCO3↓+2NaOH,Ca(OH)2+K2CO3 ==Na2CO3+2KOH。
检验二氧化碳气体是否与氢氧化钠溶液反应的方法
通常情况下,将二氧化碳气体直接通人装有氢氧化钠溶液的试管中,很难直接判断二氧化碳气体是否与氢氧化钠溶液反应。因此,要判断二氧化碳气体确实能与氢氧化钠反应,可以采取如下两种方法:
(1)检验产物的方法:验证通入二氧化碳气体后的溶液中是否含有碳酸钠,检验碳酸根离子是否存在。通常检验碳酸根离子的方法是:
方法1:取样,加入稀盐酸,并将产生的气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明溶液中存在碳酸根离子。
方法2:取样,加入氢氧化钙溶液,若产生白色沉淀,则证明溶液中存在碳酸根离子。上述两种方法其实也可以检验氢氧化钠溶液是否变质.而且方法I还可以用于除去变质后的氢氧化钠溶液中的碳酸钠。
(2)改进实验装置,通过一些明显的实验现象间接证明二氧化碳气体能与氢氧化钠反应。如:
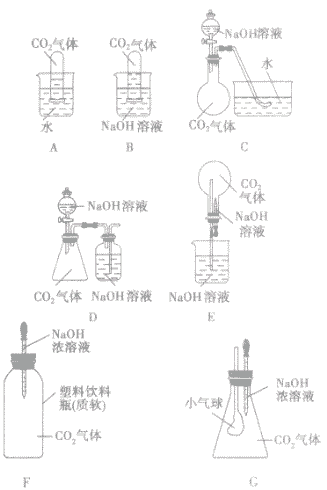
| 所选装置 | 操作方法 | 实验现象 |
| A | 将充满二氧化碳的试管倒扣在水中 | 试管内的液面略有上升 |
| B | 将充满二氧化碳的试管倒扣在氢氧化钠溶液中 | 试管内的液面明显上升 |
| C | 将氢氧化钠溶液滴入烧瓶 | 水槽中的水倒吸入烧瓶内 |
| D | 将氢氧化钠溶液滴入锥形瓶 | 集气瓶中,NaOH溶液中的长导管下端产生气泡 |
| E | 将胶头滴管中氢氧化钠溶液挤入烧瓶 | 烧瓶内产生“喷泉” 现象 |
| F | 将胶头滴管中的氢氧化钠溶液挤入软塑料瓶 | 塑料瓶变瘪 |
| G | 将胶头滴管中的氢氧化钠溶液挤入锥形瓶中 | 小气球胀大 |
碱的命名:
一般读作氢氧化某,如:NaOH读作氢氧化钠。变价金属元素形成的碱,高价金属碱读作氢氧化某,如Fe(OH)3读作氢氧化铁,低价金属碱读作氢氧化亚某,如Fe(OH)2读作氢氧化亚铁。
氨水:
氨气的水溶液俗称氨水,主要成分是NH3?H2O,通常状况下是无色液体,具有挥发性。浓氨水能挥发出具有刺激性气味的氨气NH3。
氨水显碱性,能使指示剂变色。
氨水的组成中含有N元素,因此可通过与酸反应生成铵盐来制氮肥,其本身也是一种氮肥。在化学实验中一般可用浓氨水做分子运动的探究实验。
相关初中化学知识点:碱的用途
常见的碱的用途:
1. 氢氧化钠:是重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业。实验室中可作干燥剂。
2. 氢氧化钙:用于建筑业,制漂白粉,改良土壤。常用于实验室二氧化碳的检验。
本文来自:逍遥右脑记忆 /chuzhong/263168.html
相关阅读:瑞典
关于乐果的初中化学知识百科
初中化学?电木的来历
初中课外化学实验 检验含碘食盐成分中的碘
德国化学家?瓦拉赫
